3. Juli 2023
Einblicke in das Recycling unserer Zellen
Forschenden am FIAS ist ein bedeutender Durchbruch im Verständnis der Autophagie gelungen, einem lebenswichtigen zellulären Mechanismus für Abbau und Recycling beschädigter Zellbestandteile. Ihre in Zusammenarbeit mit Expert:innen des Francis Crick Institute in London und der Universität Tokio gewonnenen und in Science Advances veröffentlichten Erkenntnisse beleuchten die Rolle eines bestimmten Proteins in diesem Prozess, ATG3. Dies ebnet den Weg für das Verständnis einer gestörten Autophagie, wie sie bei neurodegenerativen Erkrankungen und Krebs vorkommt.
Zellen besitzen eine ausgeklügelte "Recyclingsystem", die Autophagie. Dieser griechische Begriff bedeutet "Selbstverzehr" und ist ein komplexer Prozess. Alle Zellkomponenten - wie kleine Moleküle, Zucker, einzelne Proteine, Lipide - sind in einer enorm komplexen Choreografie organisiert, die für das korrekte Funktionieren der Zelle und letztlich für die Gesundheit und das Überleben des gesamten Organismus notwendig ist. Manchmal werden Teile dieser Choreographie beschädigt - etwa ein Proteinkomplex oder eine Membran - und die Zelle muss sie beseitigen, bevor sie ihre normale Funktion beeinträchtigen. Oder eine Zelle leidet unter Nährstoffmangel, sodass sie vorhandene Moleküle nutzen und recyclen muss, um sich auf wesentliche Aktivitäten zu konzentrieren. In diesen Situationen wird die Autophagie aktiviert.
Autophagie beruht auf dem Zusammenwirken zahlreicher regulatorischer Proteine, die die Bildung dieser zellulären „Müllabfuhr“ steuern. Sie sammeln den zum Recycling bestimmten Zellinhalt - beispielsweise defekte Proteine - in Bläschen, den Autophagosomen. Eine entscheidende Rolle bei der Bildung dieser Autophagosomen, den Strukturen, die das abzubauende Material einkapseln, spielt das Protein ATG3.
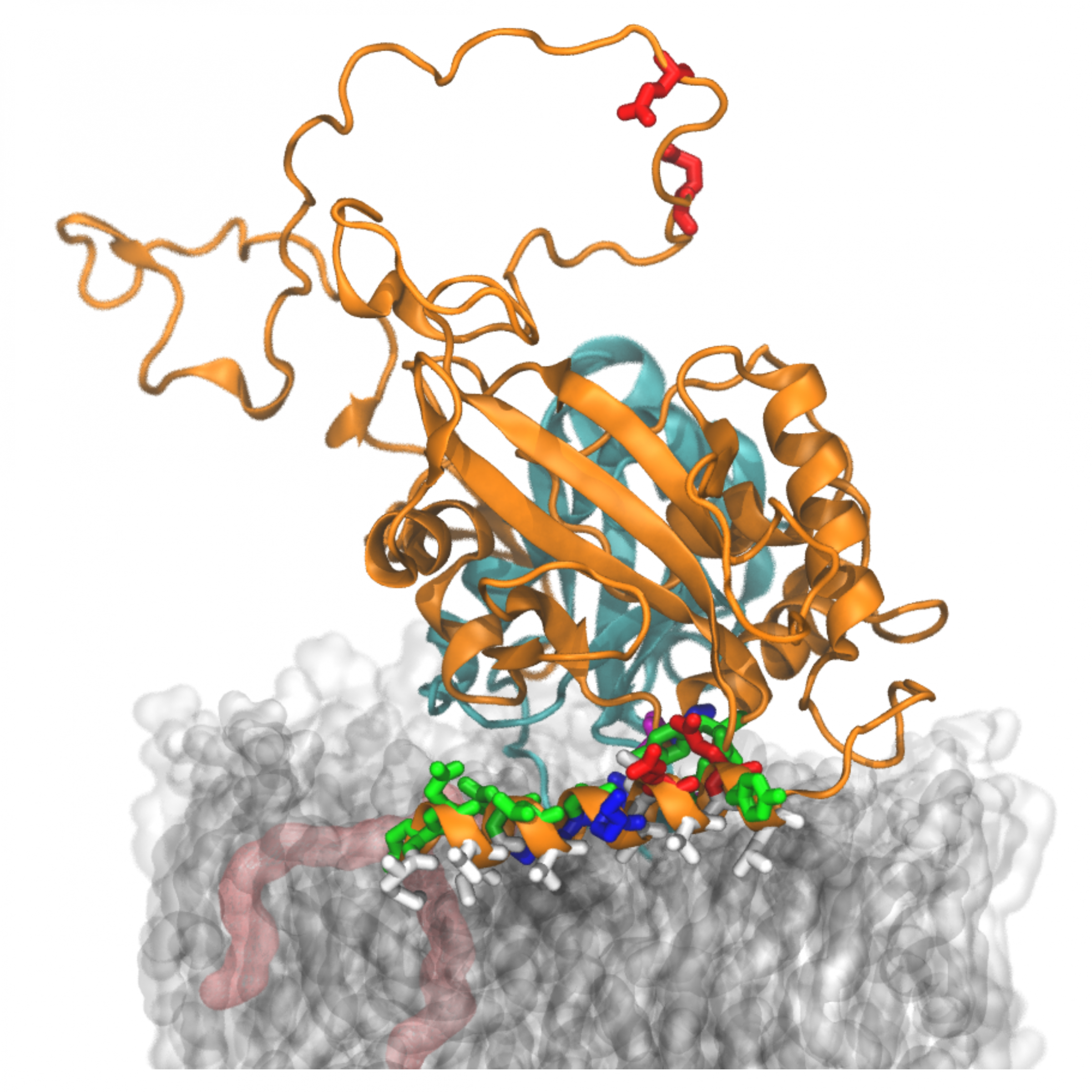
Das Forscherteam um FIAS-Fellow Roberto Covino konzentrierte sich auf eine bestimmte Seitenkette des ATG3-Proteins, die amphipathische α-Helix (AHATG3). Sie fanden heraus, dass diese Seitenkette über einzigartige biophysikalische Eigenschaften verfügt: Diese Eigenschaften ermöglichen es ihr, streng kontrolliert mit Membranen zu interagieren. Und sie sind für die Funktion des Proteins bei der Autophagie wesentlich.
Mithilfe modernen Computertechniken, die die Forschenden mit zellbiologischen Experimenten kombinierten, simulierten und beobachteten sie die Dynamik des ATG3-Proteins und seine Interaktion mit Membranen während des Autophagie-Prozesses. Sie fanden heraus, dass die einzigartigen Eigenschaften von ATG3 für einen Schlüsselschritt bei der Autophagosomenbildung entscheidend sind.
Dieses tiefere Verständnis der molekularen Mechanismen, die der Autophagie zugrunde liegen, könnte erhebliche Auswirkungen auf die Entwicklung von Behandlungen für Krankheiten haben, die mit einer gestörten Autophagie einhergehen, wie etwa neurodegenerative Erkrankungen und Krebs.
Publikation:
Taki Nishimura, Gianmarco Lazzeri, Noburu Mizushima, Roberto Covino, Sharon A. Tooze, Unique amphipathic α helix drives membrane insertion and enzymatic activity of ATG3, Science Advances 9:25, 2023, DOI: 10.1126/sciadv.adh1281
Abbildung: Computersimulation des Proteinkomplexes ATG3 (orange) auf einer Lipidmembran (grau/transparent). Die Forschenden identifizierten den auf der Membran liegenden Teil (eine amphipathische Helix) als entscheidend für den Prozess der Autophagie. Dieser grundlegende Recycling-Prozess in unseren Zellen ist bei bestimmten Krankheiten gestört. (Gianmarco Lazzeri & Roberto Covino/FIAS)
Kontakt:
Dr. Roberto Covino, FIAS
Tel.: +49 69 798 47659
covino_at_fias.uni-frankfurt.de